La ricerca clinica è una delle fasi fondamentali del processo di realizzazione di un farmaco, e la sua importanza è testimoniata dalla notevole quantità di risorse che le aziende farmaceutiche le dedicano, sia in termini economici che temporali.
Proprio per questa sua strategicità, le aziende farmaceutiche hanno iniziato a valutare la possibilità di ricorrere all’innovazione digitale per supportare tutte o parte delle attività di cui si compone la ricerca biomedica.
Un contributo utile per affrontare questo tema è stato offerto dalla Dottoressa Antonella Levante, Vice Presidente IQVIA, che è intervenuta durante la panel discussion “L’evoluzione della ricerca biomedica grazie all’innovazione digitale” che si è tenuta durante Frontiers Health Italia 2022.


Antonella Levante è Vice Presidente di IQVIA, dove attualmente ricopre il ruolo di responsabile della divisione Real World and Health Care Solutions per l’Italia, a guida di un gruppo di oltre 150 professionisti dedicati a servizi di accesso, evidence generation, decentralzied clincial trials e patients support programs destinati alle aziende Life Sciences, oltre a servizi e tecnologie destinate alla Digitalizzazione della Sanità, rivolte ad Istituzioni Sanitarie, a livello Nazionale, Regionale e Territoriale.
Lo stato attuale della ricerca clinica
Potendo disporre dei dati a disposizione di IQVIA, la Dottoressa Levante ha descritto l’attuale stato della ricerca clinica a livello globale, caratterizzata da una grande vitalità. Infatti, nel 2021 nel mondo sono state approvate 84 nuove sostanze attive (NAS), ben il doppio rispetto a cinque anni fa. Inoltre, si sono avviate oltre 5,500 sperimentazioni cliniche, ed il numero di pazienti arruolati (escludendo gli studi COVID) è cresciuto di quasi il 40% rispetto al 2020.
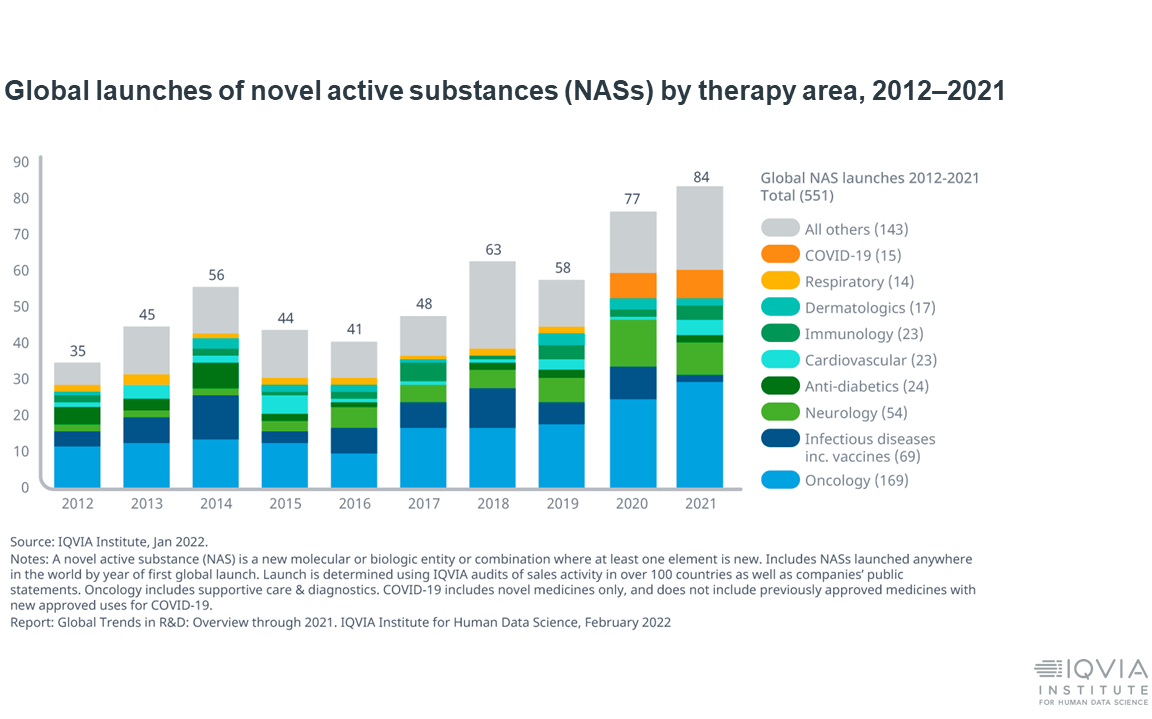
Detto ciò, Antonella Levante ha sottolineato che esiste una criticità in relazione alla produttività dello sviluppo clinico, in costante diminuzione dopo il picco raggiunto nel 2015. Le cause di questa tendenza sono da ricercare nella sempre maggiore complessità degli studi e nel minor tasso di successo delle sperimentazioni. Inoltre, la crescente complessità dei clinical trials sta rendendo sempre più difficoltoso reclutare i pazienti, tanto che sempre più spesso questo processo deve essere guidato dal sequenziamento genomico.
Proprio per essere in grado di massimizzare il reclutamento dei pazienti, e cercare di recuperare almeno parte della produttività della ricerca biomedica, una delle strategie messe in campo è quella della razionalizzazione del numero di centri clinici coinvolti negli studi.
Gli IRCCS italiani, centri deputati alla ricerca clinica nel nostro paese, non devono perdere questa opportunità, anche se, pur essendo un insieme di eccellenze, troppo spesso non fanno network e agiscono individualmente. Occorre tuttavia essere consapevoli che i centri “Tech Enabled”, meglio se operanti in reti di eccellenza, con un livello di struttura digitale tecnologica evoluta saranno sempre più un fattore differenziante per vincere la concorrenza. Pertanto, tutto ciò può essere di supporto in questo senso, come la digitalizzazione e l’automatizzazione delle diverse fasi dei processi di ricerca e reclutamento, ha un ruolo importante nel far sì che i centri di ricerca italiani in futuro continuino ad avere una loro parte in questa dimensione fondamentale dell’innovazione.
Le sfide da affrontare: digitalizzazione e conoscenze
Le maggiori sfide che attualmente gli IRCCS italiani si trovano a dover affrontare riguardano due ambiti chiave: la digitalizzazione e l’upskilling degli organici. La prima sfida potrà essere considerata vinta nel momento in cui sarà completato lo sviluppo di infrastrutture digitali che consentano di gestire la governance e di condurre la ricerca clinica. In tal modo, attraverso questi strumenti verrà facilitata la raccolta e il trattamento di dati sanitari e clinici utili alla ricerca.
La seconda sfida, che può essere ritenuta una precondizione per affrontare la prima, riguarda la necessità di acquisire competenze di data science a vari livelli, così da essere in grado di estrarre evidenze dai real world data ottenuti dalla pratica clinica. Rispondere a tale bisogno, inoltre, renderà necessario intervenire sull’adeguamento degli organici, inserendo nuovi ruoli e profili professionali, indispensabili per poter operare secondo le nuove modalità di ricerca.
Gli interventi per favorire lo sviluppo della ricerca clinica
Ampliando l’orizzonte della sua analisi, Antonella Levante ha posto al centro dell’attenzione anche alcuni interventi che dovrebbero essere affrontati urgentemente a livello nazionale, in modo da creare un sistema normativo in grado di favorire lo sviluppo della ricerca clinica.
- La necessità di dare concreta attuazione al Regolamento Europeo 536 del 2014 per la ricerca clinica. Questa norma stabilisce regole uniformi a livello europeo per armonizzare il processo di valutazione e autorizzazione di uno studio clinico condotto in più Stati membri. Si stima che la mancata armonizzazione della legislazione nazionale in tal senso stia mettendo a rischio un quarto dei nuovi studi nel solo 2022 e il 40% di quelli che saranno avviati nel 2023;
- l’esigenza di rielaborare il quadro normativo relativo al riutilizzo dei dati, in modo che si raggiunga un migliore bilanciamento tra la tutela della privacy ed i benefici sociali che si possono ottenere dalla ricerca, non profit e for profit, se fosse consentito l’uso secondario dei dati sanitari;
- l’importanza di creare un contesto normativo e culturale favorevole allo svolgimento di iniziative di collaborazione in sinergia con il mondo industriale, ad oggi ostacolato principalmente dalla disciplina sul conflitto d’interessi (ex art. 6, D. Lgs. 52/2019). In realtà sono state emanate delle norme meno stringenti a tal riguardo, ma nel caso della L. 3/18 “Decreto Lorenzin” non sono stati pubblicati i decreti attuativi necessari per rendere operativo tale provvedimento, mentre per quel che riguarda l’articolo 11bis della Legge 17 luglio 2020, il cosiddetto ‘Decreto Rilancio’, occorre ancora valutarne l’effettiva efficacia.
EU Health Data Space
Un altro elemento da tenere in considerazione è l’iniziativa “EU Health Data Space”, lanciata formalmente il 3 Maggio dalla Commissione Europea. Questo progetto, che rappresenta un’opportunità per l’ambito life science italiano, ha come obiettivo il miglioramento dell’uso dei dati sanitari per la ricerca, l’innovazione e l’elaborazione delle politiche sanitarie, all’interno di un quadro giuridico comune in cui interoperabilità e sicurezza diventeranno requisiti obbligatori.
Ciò comporterà un’accelerazione nell’adozione di standard che rendano i dati digitali riutilizzabili secondo processi standard e strutturati. La conseguenza di ciò sarà la realizzazione di un’architettura di interoperabilità per la riqualificazione dei SIS, che eviti frammentazione e duplicazione di dati e crei un Sistema Informativo Sanitario unificato a livello nazionale.
Conclusioni
Infine, per alimentare la ricerca osservazionale e, di conseguenza, ottenere ricadute importanti sia per la presa in carico dei pazienti (migliorando diagnostica, aderenza ed appropriatezza) che per la ricerca, è essenziale agire sulla digitalizzazione dell’intera pratica sanitaria. Ciò sarà fondamentale anche nel momento in cui si riuscirà ad orientare il modello di rimborso secondo indirizzi “value based”, vale a dire puntando ai migliori outcome clinici a parità di spesa, e stimolando la corretta presa in carico piuttosto che incentivando i volumi/consumi.
Questi ultimi concetti possono essere riassunti in una keyword espressa a conclusione del suo intervento, con la quale Antonella Levante sintetizza la sua idea di connessione esistente fra digitale e ricerca clinica: #Sistemadelvalore, questo è il fine a cui dobbiamo puntare.
La registrazione integrale dell’evento #FHITA22 è disponibile qui




