Questo articolo è parte di una serie dedicata alle Terapie Digitali, a cura di Jovan Stevovic, CEO e co-founder di Chino.io.
Germania: Fast-Track per le DiGA
Con il termine DiGA si intendono le app medicali digitali idonee per il rimborso secondo il DVG – Digital Healthcare Act – legge tedesca approvata nel novembre 2019.
Il governo tedesco classifica le DiGA come app digital health e il BfArM è responasbile della valutazione per l’accesso al piano di rimborso nazionale.
Per conseguire il rimborso per le terapie digitali in Germania, è necessario:
- Fornire la certificazione CE come dispositivo medico e conformità con il GDPR.
- Presentare una dimostrazione dei requisiti generali (protezione dei dati, sicurezza, interoperabilità e semplicità di utilizzo)
- Fornire prova di una valutazione scientifica volto al miglioramento delle condizioni di salute attraverso studi clinici dedicati.
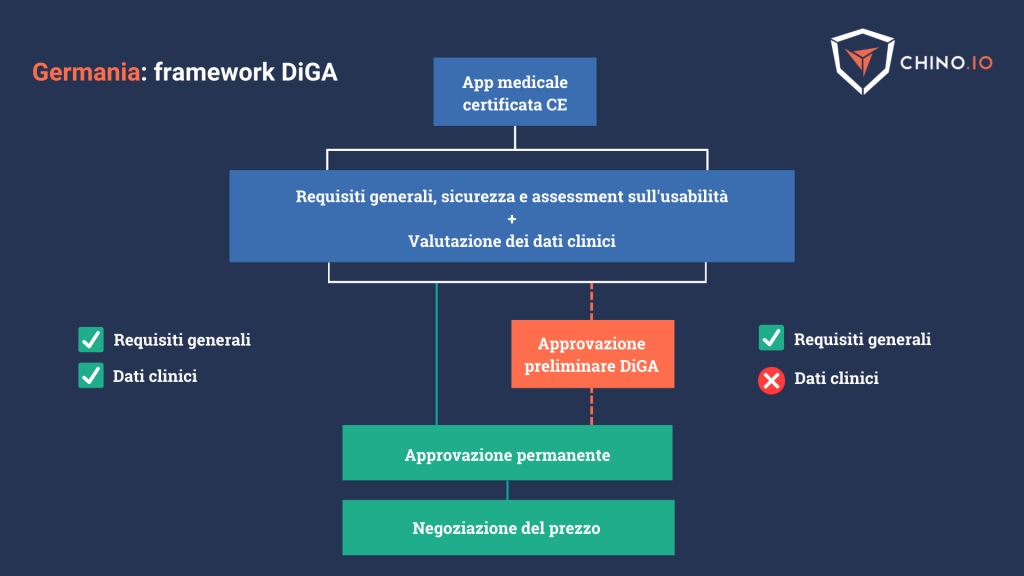
Attualmente, queste app vengono inserite nell’elenco attraverso una procedura conosciuta come Fast-Track. Una volta ricevuta l’approvazione, le app diventano disponibili ufficialmente, venire prescritte dai medici e rimborsate dalle assicurazioni.
DiPA: il nuovo framework per l’assistenza infermieristica
La Germania ha creato e approvato anche DiPA, schema di rimborso per le app sviluppate per l’assistenza infermieristica e legate alle cure a lungo-termine.
Il framework riprende i principi delle DiGA ma con qualche modifica:
- Il rimborso può coprire il costo massimo di €50/m: se superiore, il paziente dovrà coprire la quota rimanente.
- La compagnia assicurativa è responsabile dell’attivazione del prodotto per ogni paziente.
- Le app non devono necessariamente essere certificate come SaaMD (Software as a Medical Device) per accedere al rimborso.
Francia: sulle orme del Fast-Track tedesco
A fine 2021, il presidente Macron ha annunciato l’impegno della Francia nella definizione di uno schema Fast-Track per rendere le terapie digitali accessibili e rimborsabili dal sistema sanitario nazionale.
Secondo Nina Bufi, direttrice dei progetti eHealth per il Ministero della Salute francese, il fast-track può diventare un punto di svolta per la sanità francese e un vero e proprio strumento per diversificare le proposte terapeutiche esistenti.
La Francia è conosciuta per la sua rigida posizione riguardo i framework regolatori per la digitalizzazione della sanità. La fondazione del HDS (Hébergeurs de Données de Santé certification), organo aposito che autorizza l’utilizzo di fornitori approvati e certificati ne è la prova. Lo schema di certificazione è un’aggiunta ai requisiti legati al GDPR monitorati dal CNIL (autorità nazionale per la protezione dei dati).
Per raggiungere quindi la conformità alle regolamentazioni francesi (che entreranno in pieno vigore a fine 2023), le DTx devono dimostrare questi requisiti:
- Certificazione CE come SaaMD.
- Conformità con il GDPR.
- HTA (Health Technology Assessment) svolto dal CNEDIMT e HAS.
- Valutazione clinica della soluzione e benefit per il paziente.
- Dimostrazione del valore clinico e socio-economico aggiunto.
Belgio: la piramide di validazione per mHealth
Il Belgio sta seguendo i passi intrapresi da Germania e Francia, con la prima app già approvata per il rimborso (per un periodo temporaneo durante lo svolgimento del trial clinico).
Per ricevere il via libera, è necessario raggiungere il vertice della piramide di validazione per le tecnologie mHealth e superare la valutazione del FAMHP (Fereal Agency for Medicines and Health Products).
- Livello M1: Valutazione del marchio CE e conformità con il GDPR.
- Livello M2: Valutazione dei rischi per la sicurezza dei dati, riservatezza dei dati medicali, connettività e interoperabilità.
- Livello M3: Dimostrazione clinica e socio-economica del valore aggiunto portato dalla soluzione.
Le app che superano il livello M3 diventano idonee al rimborso attraverso il NIHDI (National Institute for Health and Disability Insurance). Al momento ci sono 34 app medicali al livello M1 e M2.
Regno Unito: da NHS App Library a DTAC
Era aprile 2017 quando NHS ha lanciato la sua App Library, un vero e proprio database di strumenti digital health fruibile dai pazienti per aiutarli a fare scelte migliori in ambito di salute digitale.
Definitivamente chiusa nel dicembre 2021, al suo posto ora troviamo DTAC (Digital Technology Assessment Criteria), il nuovo standard per garantire che le app digital health soddisfino gli standard NHS per quanto riguarda sicurezza, protezione dei dati, interoperabilità, usabilità e accessibilità.
Per essere approvate, le DTx nel Regno Unito devono dimostrare:
- Certificazione CE/UKCA come SaaMD
- Conformità al GDPR/UK GDPR
- Conformità con i requisiti imposti dal DTAC sotto approvazione di NICE (National Institute for Health and Care Excellence’s).
Stati Uniti: copertura assicurativa per le DTx
Gli Stati Uniti definiscono le terapie digitali come “software per applicazioni mobile volte a diagnosticare, curare, alleviare e/o prevenire patologie o altri problemi che colpiscono il corpo umano”. La maggior parte delle DTx disponibili sono infatti classificate come dispositivi medicali di Classe II secondo FDA che le claissifica in base alla destinazione d’uso del prodotto e livello di rischio per il paziente.
Per ottenere lo status di conformità, le DTx vengono esaminate dalle Medical Technology – Digital Formulary Committees che considerano:
- Data di presentazione della richiesta a FDA (è un prerequisito ma non garantisce la copertura)
- Dati clinici peer-reviewed – che consentono di comprovare clinicamente il beneficio dell’applicazione e giustificarne quindi il prezzo.
- Dati HEOR per mostrare i benefici in termini di prezzo o il risparmio.
Bisogna ricordare che, in aggiunta all’approvazione da parte di FDA, le app devono essere conformi a HIPAA per lo scambio dei dati sensibili (PHI) con le entità interessate (cliniche, ospedali, ecc.).
Italia: siamo pronti per le DTx?
Ad oggi si contano più di qualche decina di terapie digitali approvate in tutto il mondo: da Velibra e Kalmeda in Germania, a Moovcare in Francia fino a EndeavorRX (videogioco per bambini affetti da disabilità e ADHD) in USA.
Purtroppo, la situazione in Italia non è ancora al passo con i Paesi già citati in questo articolo. Molte sono le cause che incidono nell’attuale situazione italiana e tra tutte, l’aspetto regolatorio è quello che conta più deficit.
L’AIFA ha cominciato a muovere i primi passi verso la regolamentazione delle terapie digitali ma sono ancora numerose le incognite che riguardano la potenziale procedura di rimborso. Rimangono molti infatti i quesiti senza risposta, tra cui:
- Quali sono le condizioni per prescrivere il farmaco digitale?
- Come confrontare la loro efficacia paragonata alle terapie tradizionali?
- Quale organo è responsabile per il rimborso?
- Le DTx avranno diritto alle stesse condizioni di rimborso dei farmaci tradizionali?
Il gruppo Terapie Digitali per Italia #DTxITA ha elaborato un documento che affronta tutti gli aspetti chiave per l’introduzione delle terapie digitali in Italia e che fungeranno da base di discussione con tutti gli attori coinvolti – istituzioni sanitarie, AIFA, Ministero della Salute, Istituto Superiore di Sanità, e società scientifiche.



